Los electrones de valencia son los electrones que se encuentran en los mayores niveles de energía del átomo, siendo éstos los responsables de la interacción entre átomos de distintas especies o entre los átomos de una misma.
Estos electrones, conocidos como "de valencia", son los que presentan la facilidad, por así decirlo, de formar enlaces. Estos enlaces pueden darse de diferente manera, ya sea por intercambio de estos electrones, por compartición de pares entre los átomos en cuestión o por el tipo de interacción que se presenta en el enlace metálico, que consiste en un "traslape" de bandas. Según sea el número de estos electrones, será el número de enlaces que puede formar cada átomo con otro u otros.
Tipos de enlace
Enlace covalente
Teoría del Enlace de Valencia
En química, la teoría del enlace de valencia explica la naturaleza de un enlace químico en una molécula, en términos de las valencias atómicas.[1] La teoría del enlace de valencia resume la regla que el átomo central en una molécula tiende a formar pares de electrones, en concordancia con restricciones geométricas, según está definido por la regla del octeto. La teoría del enlace de valencia está cercanamente relacionada con la teoría del orbital molecular.
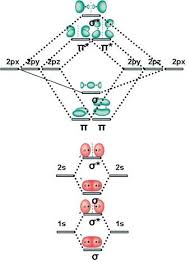
Teoría de los orbitales moleculares
En química, la Teoría de los Orbitales Moleculares (OM), es un método para determinar la estructura molecular en la que los electrones no están asignados a enlaces individuales entre átomos, sino que se toman con un movimiento que está bajo la influencia de los núcleos de toda la molécula.[1] En esta teoría, cada molécula tiene un grupo de orbitales moleculares, y se asume que la función de onda ψf del orbital molecular está escrita como una simple suma entre los n orbitales atómicos constituyentes χi, de acuerdo a la siguiente ecuación.:[1]


No hay comentarios:
Publicar un comentario